文章来源:中华神经科杂志, 2024, 57(1): 10-23.
作者:中华医学会神经病学分会神经免疫学组
摘要
多发性硬化(MS)是一种免疫介导的中枢神经系统炎性脱髓鞘疾病,其病变具有时间多发与空间多发的特征。在过去的10年中,MS在流行病学、病理学、疾病活动与进展等领域的相关研究推动了该病临床分型、诊断标准、治疗目标的更新,新的疾病修正治疗药物也为治疗策略提供了更多选择。中华医学会神经病学分会神经免疫学组通过查询和评价现有研究证据、参考国际共识和指南、结合国情、反复讨论,对中国MS患者提出了诊断、鉴别诊断、治疗的原则以及具体建议。
多发性硬化(multiple sclerosis,MS)是一种免疫介导的中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病,病变具有时间多发(dissemination in time)与空间多发(dissemination in space)的特征。MS病因尚不明确,Epstein-Barr病毒感染、低血清维生素D水平、日晒不足、吸烟、青少年时期肥胖等可能为MS发病的危险因素 [ 1 , 2 , 3 , 4 ] 。
在过去的10年中,MS在流行病学、病理学、疾病活动与进展等领域研究推动了临床分型、诊断标准、治疗目标的更新,新的疾病修正治疗(disease modifying therapy,DMT)药物为治疗策略提供了更多选择。因此,中华医学会神经病学分会神经免疫学组对中国MS的诊断与治疗指南进行了重新修订。
概论
MS好发于29~39岁,女性更为多见,男女患病比例为1∶1.5~1∶2 [ 3 , 5 ] 。MS有明显的地域分布及人种差异,高纬度高海拔地区更易发生MS,亚洲、非洲、拉丁美洲人群患病率明显低于欧美高加索人种。近年来MS的发病率及患病率有逐渐增高趋势。一项基于中国住院患者的流行病学资料显示,中国整体人群MS发病率为0.235/10万人年,成人男女患者比例为1∶2.02 [ 5 ] 。2018年MS被列入中国《第一批罕见病目录》 [ 6 ] 。
MS病变可以累及CNS白质及灰质;急性期表现为以T淋巴细胞介导的小静脉周围炎症,继发髓鞘脱失,伴有不同程度的轴索损伤 [ 7 ] ;进展型MS病理显示更为严重的白质和灰质脱髓鞘、轴突缺失、脑膜炎性改变及灰质受累。近年来发现,在大脑皮质血管周围间隙附近的软脑膜中可见异位淋巴滤泡样结构(follicle-like structure),包含增殖的B淋巴细胞、浆细胞、辅助性T淋巴细胞和滤泡树突状细胞网络,具有生发中心功能,与MS灰质病变密切相关 [ 8 ] 。这些炎症的区隔化,包括激活的B细胞、小胶质细胞,共同参与了慢性炎症过程 [ 9 ] 。“阴燃疾病” [ 10 ] 是近些年逐渐认识的慢性病理学过程,与神经退行性变相关,在疾病早期即可发生,并在整个病程中持续。“阴燃”炎症活动,包括慢性活动性病变和皮质病变。在影像学上可表现为缓慢扩大的病变(slowly expanding/evolving lesions)和顺磁性边缘病变(paramagnetic rim lesions),小胶质细胞的过度活化可能是形成和发展的主要驱动因素。
一、MS的疾病分型
结合临床表现,残疾进展及MRI影像特征将MS临床病程分型如下 [ 11 ] 。
1.临床孤立综合征(clinically isolated syndrome,CIS):指患者首次出现CNS炎性脱髓鞘事件,引起的相关症状和客观体征至少持续24 h,且为单相临床病程,类似于MS的1次典型临床发作,为单时相临床病程,需排除其他原因如发热或感染事件。60%~70%的患者在满足时间多发、空间多发,并排除其他诊断,即可明确诊断为MS [ 12 , 13 ] 。典型的CIS可表现出视神经、幕上、幕下(脑干或小脑)、脊髓症候,可以是单个或多部位同时受累。
2.复发缓解型MS(relapsing remitting multiple sclerosis,RRMS):病程表现为明显的复发和缓解过程,每次发作后不留或仅留下轻微症状。80%~85%的MS患者疾病初期表现为本类型。
3.继发进展型MS(secondary progressive multiple sclerosis,SPMS):约50%的RRMS患者在患病10~15年后疾病不再或仅有少数复发,残疾功能障碍呈缓慢进行性加重过程。RRMS向SPMS的转化往往是缓慢渐进的,至今仍缺乏较为明确的标准,经常是通过残疾功能障碍评分结合临床及影像资料综合得出的回顾性结论。
4.原发进展型MS(primary progressive multiple sclerosis,PPMS):10%~15%的MS患者残疾功能障碍与临床复发无关,呈缓慢进行性加重,病程大于1年。PPMS分型包括原有MS疾病分型中的进展复发型MS(primary relapsing multiple sclerosis,PRMS)。头颅MRI和(或)脊髓MRI具备典型MS病灶特征,脑脊液特异性寡克隆区带(oligoclonal bands,OCB)常为阳性。
二、MS相关概念
1.疾病炎症相关活动(inflammatory disease activity):分为临床和影像两个维度。在无发热或感染的情况下,出现临床复发和(或)磁共振成像(magnetic resonance imaging,MRI)出现T 1WI钆增强病变或新的或明确扩大的T 2WI病变。
2.确定的残疾进展(confirmed disability progression,CDP):定义为临床残疾功能障碍较基线时的进展。通常以3个月或6个月的扩展残疾功能量表(Expanded Disability Status Scale,EDSS)评分增加作为衡量标准。具体标准为基线EDSS评分≤5.5分者,增加≥1.0分;基线EDSS评分>5.5分者,增加≥0.5分或25英尺步行用时增加≥20%或9孔钉柱测试用时增加≥20% [ 14 ] 。
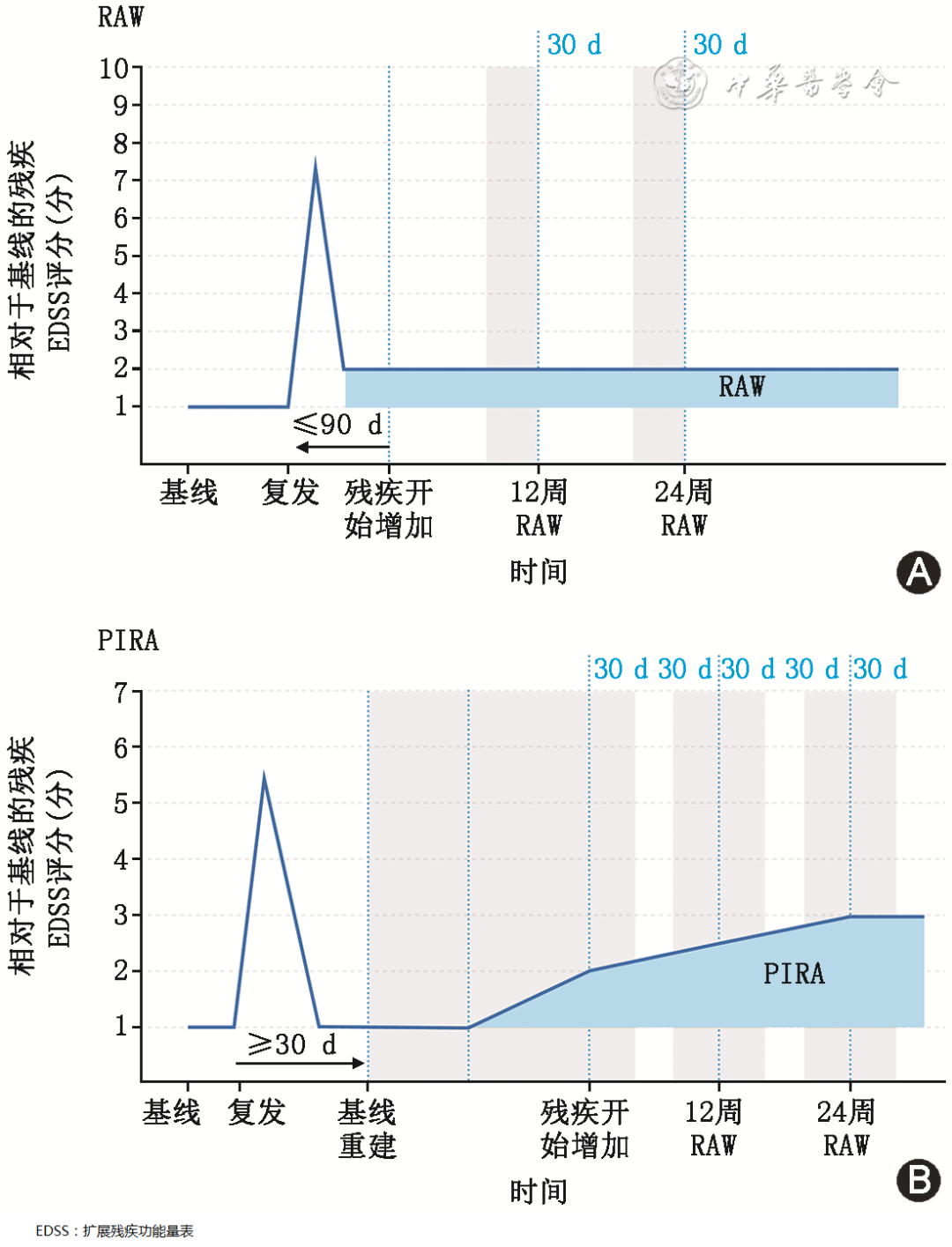
3.复发相关恶化(relapse associated worsening,RAW):指与临床复发相关的残疾功能障碍的增加。即在临床发作后90 d之内,残疾功能障碍较基线的增加 [ 15 ] ( 图1 )。
图1 复发相关恶化(RAW,A)及独立于复发活动的进展(PIRA,B)示意图(在参考文献[ 15 ]中图片的基础上自行绘制)
Figure 1 Schematic diagram (drawn on the basis of reference[ 15 ]) of relapse associated worsening (RAW, A) and progression independent of recurrence activity (PIRA, B)
4.独立于复发活动的进展(progression independent of relapse activity,PIRA):指独立于临床复发的残疾功能障碍的增加,PIRA可能是构成慢性残疾累积的重要驱动因素 [ 15 ] ( 图1 )。
5.高活动性MS(highly active multiple sclerosis):又称为侵袭性MS(aggressive MS,AMS),表现为疾病的频繁复发和MRI新增病变高度活跃[新增和(或)强化],疾病病程更具侵袭性,包括躯体和认知相关残疾功能障碍快速进展。疾病具有以下一种或几种特征:(1)发病后5年内EDSS评分达到4分或以上;(2)过去1年有≥2次未能完全缓解的复发;(3)尽管接受DMT,过去1年超过2次MRI显示新发/增大的T 2病灶或钆增强病灶;(4)对一种或多种DMT治疗1年以上仍进展。此外,符合男性,首次发病年龄>50岁;首次发作治疗后未恢复;认知障碍;脊髓、脑干病变≥2个;幕上病灶负荷大等条件患者,需要密切监测,警惕疾病进展可能 [ 16 ] 。
MS的诊断
一、诊断
MS的诊断遵循2017版McDonald诊断标准 [ 17 ] ( 表1 )。
2017年版McDonald诊断标准较2010年标准进行了以下更改:建议对于典型CIS患者,满足临床或MRI的空间多发标准,且临床无其他合理解释,脑脊液中出现OCB阳性即可诊断MS;症状性和无症状性病变均可用于证明幕上、幕下或脊髓综合征患者空间多发或时间多发;皮质病变可用于证明空间多发。该标准旨在促进MS的早期诊断。
注意事项 [ 17 ] :(1)需要认识到McDonald标准不是为了区分MS和其他疾病而制定的,而是为了在其他诊断被认为不太可能的情况下,在具有典型CIS的患者中识别MS或其他疾病的高度可能性。(2)作出MS可靠诊断或替代诊断应基于具有MS相关专业知识的临床医生综合患者病史、检查结果、影像学和实验室证据,除证实空间多发和时间多发以外,必须对临床数据、影像学表现和检测结果进行严谨的解释。(3)在没有明确的典型CIS的情况下,应谨慎作出MS的诊断,并应通过临床和影像学随访来进一步确诊。在这种情况下,临床医生应考虑推迟作出明确诊断并启用长期疾病修正治疗,等待更长时间的随访以积累支持诊断的额外证据。(4)如历史事件缺乏当时发作或当前客观证据进行佐证,应更为谨慎认定为临床发作。(5)亚洲人群患病率相对较低,为了明确诊断,应在以下情况下,建议额外的辅助检查,包括脊髓MRI或脑脊液检查:①支持MS诊断的临床和脑部MRI证据不充分,尤其是考虑开始长期DMT治疗时;②出现典型CIS以外的表现,包括发病时病程进展的患者(PPMS);③出现非典型MS的临床、影像学或实验室特征;④MS不太常见的人群(例如儿童、老年人)。
二、儿童MS
2017年McDonald 诊断标准同样适用于11岁及以上的儿童。儿童MS中95%为RRMS,80%与成人MS特点相似,相关空间多发和时间多发标准同样适用;但15%~20%的儿童MS,尤其是小于11岁的患儿,疾病首次发作类似于急性脑病或急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)过程,所有MS患儿中10%~15%可有长节段脊髓炎的表现,推荐对患儿进行动态MRI随访,当观察到新的、非ADEM样发作方可诊断MS [ 18 ] 。
三、放射学孤立综合征(radiologically isolated syndrome,RIS)
患者无神经系统临床表现,MRI高度提示MS可能,同时缺乏任何其他可能的放射学病变解释,则可考虑为RIS。推荐对RIS患者进行临床和影像学(脑和脊髓MRI)定期随访。约1/3 的RIS患者发病后5年内能够诊断MS,且通常为RRMS [ 18 , 19 , 20 , 21 ] 。目前不推荐在首次脱髓鞘临床事件发生之前开始DMT治疗。
四、辅助检查
MS的诊断具有挑战性,目前尚无特异性的诊断标志物,需要结合临床及各种辅助检查的支持。
1.MRI:MRI是目前MS最可靠的辅助诊断工具,经典区域的病变特征以及空间多发和时间多发证据成为MS诊断与鉴别诊断过程中的重要依据。
空间多发:指累及不同部位的临床或影像证据,空间多发的MRI证据为:脑室周围,皮质/近皮质,幕下和脊髓4个区域中至少有2个区域存在≥1个具有MS特征的T 2WI高信号病变。
时间多发:指发作间隔1个月以上的2次临床或者影像证据,时间多发的MRI证据为:对比基线MRI,在随访MRI上扫描出现新的T 2和(或)钆增强病变,或者在任何时间点同时出现钆增强和非增强病变来实现 [ 17 ] 。
《多发性硬化MRI规范化应用专家共识》中推荐采用场强≥1.5 T(首选推荐3.0 T)的MRI用于MS的诊断 [ 22 ] 。优先推荐MRI 3D采集,建议层厚为1 mm;2D采集建议层厚≤3 mm,层间无间隔;建议行全脑MRI,应包括尽可能多的颈髓,为了便于患者后续随访进行前后对照,建议每次采集部位一致,2D成像沿胼胝体下缘连线采集;3D成像重建出斜轴位图像;脊髓MRI推荐全脊髓扫描,但如果条件受限,至少应包括颈髓,采集位置应垂直于脊髓的矢状轴。推荐诊断MS的MRI基础序列:脑部T 2WI、T 2FLAIR,脊髓T 2WI、质子加权成像(proton density weighted imaging)、短时间反转恢复(short time inversion recovery),注射对比剂前后T 1WI等序列。有条件的单位可选择弥散加权成像确立活动病变;双反转恢复(double inversion recovery)或相位敏感反转恢复(phase sensitive inversion recovery)序列可用于检测皮质或近皮质病变,高分辨率T 1WI序列可用于定量评估脑体积,磁敏感加权成像(susceptibility weighted imaging)可用于显示中央静脉征和顺磁性边缘病变特征等 [ 22 ] 。
定期进行MRI随访有助于及时识别疾病活动、评估治疗效果、预测治疗反应,调整治疗策略。建议在治疗基线首次进行MRI扫描,考虑到不同DMT起效时间不同,推荐将药物起效时间点MRI评估作为药物疗效评估基线起点。随后依据患者临床情况每6~12个月进行规律随访;可参考诊断MS的基础推荐序列,不建议常规随访应用增强序列,如临床出现明确发作或常规序列提示可疑急性期病变,推荐加做增强扫描序列 [ 22 ] 。
2.实验室检查:(1)脑脊液常规及生化:MS腰椎穿刺压力多为正常,脑脊液外观呈无色透明,单核细胞数可有轻中度升高,白细胞数一般不超过50×10 6/L,脑脊液生化葡萄糖及氯化物正常,脑脊液蛋白轻中度升高,多在1 g/L以下,其中以免疫球蛋白升高为主 [ 23 ] 。(2)脑脊液细胞学:可发现免疫活性细胞,如激活型淋巴细胞、浆细胞和激活型单核细胞,急性期常以小淋巴细胞为主,伴有激活型淋巴细胞和浆细胞,偶见多核细胞,是疾病活动的标志;缓解期多为激活的单核细胞和巨噬细胞,发作间期细胞学可完全正常 [ 23 ] 。(3)IgG鞘内合成:鞘内IgG合成的检测是临床诊断MS的一项重要辅助指标。MS患者脑脊液中免疫球蛋白增加,其主要是IgG升高 [ 24 ] 。(4)IgG指数:IgG指数是反映IgG鞘内合成的定量检测指标,70%~75%的MS患者该指数增高。IgG指数计算公式为:(脑脊液-IgG/血清-IgG)/(脑脊液-白蛋白/血清-白蛋白),其上限值为0.7,超过该值提示IgG鞘内合成增加 [ 25 , 26 ] 。判定IgG鞘内合成的前提是脑脊液-白蛋白/血清-白蛋白的比值正常,该比值提示血脑屏障的功能正常。病程中连续2次检测脑脊液-白蛋白/血清-白蛋白比值正常,而脑脊液-IgG/血清-IgG比值增高4倍以上时,可确认有鞘内合成。(5)OCB:是IgG鞘内合成的重要定性指标,通过等电聚焦结合免疫化学检测IgG来分析脑脊液OCB,脑脊液和血清样本必须同时配对分析,在pH值3.0~10.0区域,出现2条及以上狭窄且不连续的条带为OCB阳性。通常OCB结果可以分为5种模式:Ⅰ型是指正常血清和正常脑脊液,无鞘内IgG合成。Ⅱ型为仅在脑脊液中可见OCB(存在鞘内IgG合成),而血清正常。Ⅲ型为血清和脑脊液中均见OCB,但脑脊液中出现血清中不存在的、额外的OCB条带(存在鞘内IgG合成)。Ⅳ型是指血清和脑脊液中存在对称性分开的OCB条带(对称模式,没有鞘内IgG合成)。Ⅴ型为单克隆条带,分别在血清和脑脊液中出现对称性密集的条带(无鞘内IgG合成)。Ⅳ型和Ⅴ型区带需要结合血脑屏障及临床疾病分析其意义 [ 27 ] 。60%~95%的MS患者可在脑脊液中检出。Ⅱ型、Ⅲ型OCB阳性,支持MS诊断 [ 24 , 28 , 29 ] 。
推荐意见:对于临床怀疑MS患者,需尽早完善脑脊液常规、生化、细胞学、IgG合成率及OCB等常规及免疫相关检测项目。同时应该完善血清或脑脊液水通道蛋白4(aquaporin 4,AQP4)-IgG及髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)-IgG筛查以鉴别。
3.其他辅助检查:(1)视觉诱发电位(visual evoked potential,VEP):P100潜伏期延长提示可能脱髓鞘,波幅降低提示可能轴索损伤,VEP可帮助发现临床及亚临床病变;但是受很多因素影响,缺乏疾病特异性。(2)光学相干断层扫描(optic coherence tomography,OCT):通过视网膜神经纤维层(retinal nerve fiber layer)厚度来反映神经轴索损伤程度。OCT有助于帮助评价临床及亚临床病变,但是受很多因素影响,缺乏疾病特异性。
4. MS的鉴别诊断:对于早期的MS,应注意与其他临床及影像上同样具有空间多发和时间多发特点的疾病进行鉴别,尤其是具有非典型临床或MRI表现红旗征(red flag)的患者 [ 30 ] ( 表2 )。尽可能完善实验室及其他相关辅助检查,排除其他更好解释临床和放射学发现的可能疾病,切忌仅凭脑室周围多发长T 2信号就片面地作出MS的诊断。
需与MS鉴别的疾病包括:其他CNS炎性脱髓鞘病、系统性自身免疫性疾病、感染性疾病、遗传代谢性疾病、肿瘤性疾病、血管性疾病以及功能性疾病等。在中国尤其应注意排除视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders)及髓鞘少突胶质细胞糖蛋白抗体相关疾病(myelin oligodendrocyte glycoprotein antibody associated diseases),建议进行AQP4-IgG及MOG-IgG的检测 [ 30 ] 。
MS的治疗
一、治疗原则
MS一经明确诊断,应尽早开始DMT并长期维持治疗,推荐患者共同参与制定治疗决策,设立明确的治疗目标及随访计划,定期评估,在确保安全的前提下尽快达到治疗目标 [ 18 , 31 , 32 ] 。
二、治疗目标
全面控制疾病炎症活动、延缓残疾进展、改善临床症状,促进神经修复,提高生活质量。目前,国际上主要通过临床、影像、生物标志物3个维度定期监测评估,实现疾病无活动证据(no evidence of disease activity,NEDA),主要指标包括:临床复发(年复发率,annualized relapse rate)、CDP(EDSS评分)、MRI(新增T 2、钆增强或扩大T 2病变)、脑容积变化减少每年<0.4%,此外神经丝轻链(neurofilament light chain)、认知功能评估(符号数字模拟试验,symbol digit modalities test)等指标也在逐渐成为可能的观察指标 [ 33 , 34 ] 。
三、治疗策略
首先需对MS患者进行充分评估,平衡安全性、有效性、经济因素、药物是否可及以及个体偏好等因素后,在循证证据的基础上制定个体化治疗策略。推荐在初始DMT或转换DMT决策时引入分层治疗逻辑;首先根据疾病病程分型;其次根据疾病的炎症相关活动以及CDP(包括RAW及PIRA),分别选取有循证依据支持的药物;同时需结合药物作用机制及可能出现不良反应、患者偏好等作出个体化选择;对于高度活动性MS患者推荐早期选择更高疗效治疗策略 [ 32 , 35 , 36 ] 。
启动DMT治疗后,推荐对患者进行全程药物安全及有效评估,当出现药物不耐受;患者个人因素(妊娠、合并症等);疾病炎症活动或残疾进展未达到治疗目标:如维持治疗超过1年时,出现1次严重或≥2次复发、MRI检查发现2个或2次以上新增病变、残疾进展,可考虑转换不同作用机制DMT药物 [ 31 , 32 , 35 ] 。
四、药物的短期及长期安全性原则
DMT在应用期间需关注药物短期及长期安全性;原则上应该建立好定期安全随访机制。需重点关注有合并症的患者或个体化人群的如下几个方面:既往疾病,如肝炎、结核感染、心脏病、糖尿病等;肝肾功能、血淋巴细胞及中性粒细胞绝对计数等;继发感染及肿瘤风险,尤其老年人、卧床患者;育龄期、妊娠期、哺乳期患者的药物禁忌。
五、MS的具体治疗方法
1.急性期治疗:治疗目标:MS的急性期治疗以减轻恶化期症状、缩短病程、改善残疾程度和防治并发症为主要目标。适应证:并非所有复发均需处理。有客观神经缺损证据且提示恶化,如视力下降、运动障碍和脊髓、小脑/脑干症状等方需治疗。轻微感觉症状或无症状影像活跃可无需治疗,一般休息或对症处理后即可缓解 [ 37 ] 。主要药物及用法如下。
(1)糖皮质激素(以下简称“激素”):已有的研究证实,激素治疗能促进急性发病的MS患者神经功能恢复(Ⅰ级证据,A级推荐);延长激素用药对神经功能恢复无长期获益(Ⅱ级证据,B级推荐) [ 38 ] 。大剂量甲泼尼龙冲击治疗(IVMP;Ⅰ级证据,A级推荐) [ 38 ] 的治疗原则:一线治疗。推荐大剂量,短疗程。具体用法:①成人从1 g/d开始,静脉滴注3~4 h,共3~5 d,如临床神经功能缺损明显恢复可直接停用。如临床神经功能缺损恢复不明显,可改为口服醋酸泼尼松或泼尼松龙60~80 mg,1次/d,每2日减5~10 mg,直至减停,原则上总疗程不超过3~4 周。若在减量的过程中病情明确再次加重或出现新的体征和(或)出现新的MRI病变,可再次给予IVMP或改用二线治疗。②儿童按体质量予以20~30 mg·kg -1·d -1,静脉滴注3~4 h,1 次/d,共5 d,症状完全缓解者,可直接停用,否则可继续给予口服醋酸泼尼松或泼尼松龙1 mg·kg -1·d -1,每2日减5 mg,直至停用 [ 39 ] 。口服激素减量过程中,若出现新发症状,可再次IVMP或给予1个疗程大剂量静脉注射免疫球蛋白(IVIG)治疗 [ 40 ] 。常见不良反应包括电解质紊乱,血糖、血压、血脂异常,上消化道出血,骨质疏松,股骨头坏死等。
(2)血浆置换:为二线治疗。急性重症或对激素治疗无效者可于起病2~3周内应用5~6 d的血浆置换(Ⅲ级证据,D级推荐) [ 38 ] 。注意事项:血浆置换需有创静脉置管,应避免导管相关感染,在置换过程中注意心脏负荷相关低血压及过敏、电解质紊乱等。
(3)IVIG:缺乏有效证据,仅作为一种备选治疗手段,用于妊娠或哺乳期妇女或不能应用激素治疗的患者 [ 38 ] (Ⅲ级证据,D级推荐)。推荐用法为:静脉滴注0.4 g·kg -1·d -1,连续用5 d为1个疗程,5 d后如果无效,则不建议患者继续使用,如果有效但疗效不是特别满意,则可继续每周用1 d,连用3~4周 [ 41 ] 。注意事项:应避免IVIG后马上进行血浆置换治疗。在治疗过程中注意心脏负荷、高血液黏稠度及过敏等。
2.缓解期治疗(DMT):目前经中国食品药品监督管理局批准,国内已经上市的DMT药物有:特立氟胺、盐酸芬戈莫德、西尼莫德、奥扎莫德、富马酸二甲酯、奥法妥木单抗、醋酸格拉替雷。
(1)特立氟胺:通过阻断嘧啶从头合成途径可逆性抑制二氢乳清酸脱氢酶,进一步抑制活化的T、B淋巴细胞增殖,同时保留保护性免疫应答 [ 42 ] 。2项关键Ⅲ期研究TEMSO [ 43 , 44 ] 及TOWER [ 45 ] 提示特立氟胺14 mg组较安慰剂组一致性显著降低年复发率(31.5%、36.3%),TOWER中国亚组数据 [ 46 ] 显示,特立氟胺降低年复发率高达71.2%。TEMSO研究提示其可显著减少MRI活动度,T 1钆增强病灶数下降80%,病灶总体积下降67% [ 43 , 44 ] ,显著减少脑容量丢失(第1年36.9%;第2年30.6%) [ 47 ] 。TEMSO核心扩展(9年)的随访数据 [ 43 , 44 ] 显示所有治疗组人群EDSS评分平均≤2.5分,12周无CDP进展的比率≤0.48。PASAT-3评分持续改善至第252周 [ 48 ] 。TOPIC研究显示特立氟胺与安慰剂相比可显著降低CIS转归为CDMS的风险,显著降低复发和新发MRI病灶的风险,并可显著延缓脑萎缩达43% [ 49 , 50 ] 。中国的真实世界研究显示特立氟胺治疗1年达到NEDA3的患者比例为79.0% [ 51 ] ,且可显著降低患者神经丝轻链的水平 [ 52 ] ,相较无DMT患者年复发率降低可达73.6%,EDSS评分从2.09分降至1.77分 [ 53 ] 。
推荐意见:适用于成人复发型MS,包括CIS、RRMS和有复发的SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:14 mg,口服,1次/d。常见不良反应:头痛、丙氨酸氨基转移酶(ALT)水平升高、腹泻、头发变薄。推荐定期监测ALT水平,若重复检查证实血清转氨酶≥正常3倍建议停药,考来烯胺和活性炭粉末口服可加速药物消除(洗脱)。
(2)盐酸芬戈莫德:芬戈莫德为鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)受体调节剂,通过结合于淋巴细胞表面的S1P受体使其保留于淋巴结而发挥作用 [ 54 ] 。3项关键的Ⅲ期药物研究中,FREEDOMS研究结果提示芬戈莫德组较安慰剂组显著减少年复发率(55%),显著降低3个月和6个月时的CDP(30%和37%),降低钆增强病灶数(82%),降低新发或扩大的T 2病灶数(74%),降低脑容量丢失风险(36%) [ 55 ] 。长达14年的LONGTERMS研究结果显示,治疗10年后,46%的患者无复发,96%和68%的患者EDSS评分分别维持在7分和4分以下 [ 56 ] 。针对10~17岁儿童患者的PARADIGMS研究结果提示芬戈莫德组较干扰素β-1a组能显著降低年复发率(82%),减少6个月时的CDP风险(80.2%),减少钆增强新发病灶数(66%),降低脑容量丢失风险(40%) [ 57 , 58 ] 。
推荐意见:适用于成人和10岁及以上且体重超过40 kg的儿童复发型MS,包括CIS、RRMS和有复发的SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:0.5 mg,口服,1次/d。起始治疗的患者和停药超过14 d后重新开始治疗的患者均需要进行首次用药6 h心电监测。常见不良反应:流感、鼻窦炎、头痛、高血压、咳嗽、腹泻、背痛和肝酶升高、疱疹病毒感染、支气管炎等,在儿童中的安全性特征与成人患者相似。推荐定期监测淋巴细胞计数、氨基转移酶水平、黄斑水肿。需注意停药后有很少量病例报道疾病出现严重恶化。
(3)西尼莫德:西尼莫德为选择性S1P1、5受体调节剂 [ 59 ] ,可阻止淋巴细胞从淋巴结外排,能穿透血脑屏障,促进髓鞘再生,起到神经修复作用 [ 60 ] 。一项针对SPMS患者的Ⅲ期关键药物研究——EXPAND结果提示,西尼莫德组较安慰剂组能显著降低年复发风险(55%)、6个月时CDP风险(26%)、钆增强病灶数(86%)、新增或扩大T 2病灶数(81%),脑容量丢失风险(23%) [ 61 ] 。进一步亚组分析结果显示,西尼莫德能降低患者6个月时确认的认知障碍风险(21%) [ 62 ] 。在扩展研究中,西尼莫德持续治疗组较从安慰剂转为西尼莫德组6个月时确认的残疾进展风险(22.3%)、年复发风险(52%)、6个月时确认的认知恶化风险(23%)均有降低 [ 63 ] 。
推荐意见:适用于成人复发型MS,包括CIS、RRMS和活动性SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:根据 CYP2C9基因型决定维持剂量。对于携带 CYP2C9 *1 *1 或 *2 *2 基因型的患者,维持剂量为2 mg/d;对于携带 CYP2C9 *1 *3 或 *2 *3 基因型的患者,维持剂量为1 mg/d;对于携带 CYP2C9 *3 *3 基因型的患者,禁用西尼莫德。开始服药时应进行4~5 d的剂量滴定,推荐每天早晨空腹或进食状态下服用1次。常见不良反应:头痛、高血压和氨基转移酶升高。推荐定期监测淋巴细胞计数、氨基转移酶水平、黄斑水肿。鉴于芬戈莫德停药后有很少量病例报道疾病出现严重恶化,需注意本药停药后出现严重恶化的可能性。
(4)奥扎莫德:奥扎莫德为高选择性S1P1和5受体调节剂,阻止淋巴细胞从淋巴结外排,并能透过血脑屏障,直接发挥神经保护作用 [ 64 ] 。2项关键Ⅲ期药物研究——SUNBEAM研究和RADIANCE研究的结果显示,奥扎莫德组较干扰素β-1a组一致性显著降低年复发率、MRI活动病灶数,同时也降低了全脑容量丢失(31%、26%)、皮质灰质容量丢失(84%、60%)和丘脑容量丢失(32%、27%) [ 65 , 66 ] 。DAYBREAK扩展研究结果显示,奥扎莫德长期治疗组年复发率持续降低至0.093,88.6%的患者无6个月确认的残疾进展,83.4%的患者年化脑容量丢失率≤0.4%,77%的患者认知功能改善或保持稳定 [ 67 ] 。
推荐意见:适用于成人复发型MS,包括CIS、RRMS和活动性SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:第1~4天0.23 mg,口服,1次/d;第5~7天 0.46 mg,口服,1次/d;第8天及之后0.92 mg,口服,1次/d。常见不良反应:鼻咽炎、转氨酶升高。重度肝损伤患者不应给予奥扎莫德治疗。开始治疗前,需要进行心电图、全血细胞计数和肝功能等检查,无需基因检测。无心脏异常,无需首剂给药监测。使用后建议定期监测淋巴细胞计数、氨基转移酶水平,有视觉症状患者需监测黄斑水肿。
(5)富马酸二甲酯:富马酸二甲酯主要通过激活Nrf2通路发挥免疫调节和细胞保护作用,包括调节细胞因子表达和免疫细胞亚型,以及对抗氧化应激损伤 [ 35 ] 。2项关键Ⅲ期药物研究——DEFINE研究和CONFIRM研究的结果提示,富马酸二甲酯组较安慰剂组一致性显著降低年复发率(49%)、3个月时确认残疾进展风险(32%)、新发或扩大的T 2病灶平均数量(78%)、钆增强病灶数(83%)和新发的非增强T 1低信号病灶(65%) [ 68 , 69 , 70 ] 。长达13年的扩展研究——ENDORSE研究结果提示,持续富马酸二甲酯治疗组年复发率为0.143,72%的患者超过10年未出现6个月的CDP [ 71 ] 。
推荐意见:成人复发型MS,包括CIS、RRMS和有复发的SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:起始剂量为120 mg,口服,2次/d;7 d后,剂量增加至240 mg,口服,2次/d,并维持。常见不良反应:潮红、腹痛、腹泻和恶心。推荐定期监测淋巴细胞计数、氨基转移酶。
(6)奥法妥木单抗:奥法妥木单抗为全人源抗CD20单克隆抗体(IgG1),通过抗体依赖性细胞和补体介导的溶解作用,选择性清除CD20阳性B淋巴细胞 [ 72 ] 。2项关键Ⅲ期药物研究——ASCLEPIOSⅠ和Ⅱ的结果显示,奥法妥木单抗组较特立氟胺组能一致性显著降低年复发率(51%和59%)、钆增强病灶数(98%和94%)、新发或扩大的T 2病灶数(82%和85%)以及3个月时的CDP风险34% [ 73 ] ;治疗第2年,近88%的患者实现NEDA3 [ 74 ] 。在新诊断患者中,治疗第2年超过90%的患者实现NEDA3,较特立氟胺组 OR值为14.68,年化脑容量丢失率仅为0.3%,6个月CDP风险较特立氟胺降低46% [ 74 ] ,3.5年安全性随访研究显示患者平均血清IgG水平保持稳定,IgM平均水平仍高于正常值下限 [ 75 ] 。
推荐意见:适用于成人复发型MS,包括CIS、RRMS和有复发的SPMS患者(Ⅰ级证据,A级推荐)。推荐用法:在第0、1和2周皮下注射20 mg;从第4周开始皮下注射20 mg,每28天1次。常见不良反应:上呼吸道感染、注射相关反应和注射部位反应。在首次使用奥法妥木单抗之前推荐进行乙肝病毒筛查,检测免疫球蛋白,完成疫苗接种。
(7)醋酸格拉替雷:醋酸格拉替雷同时具有外周及中枢免疫调节作用,通过将促炎Th1细胞转化为抗炎Th2细胞,即“旁观者抑制(bystander suppression)”,发挥抗炎作用,同时可促进神经营养因子分泌,发挥神经保护作用,促进髓鞘修复及再生 [ 76 , 77 ] 。一项关键Ⅲ期研究——PreCISe研究的结果显示,醋酸格拉替雷可显著降低CIS患者转归为CDMS的风险(45%),有效延迟转归时间 [ 78 ] 。一项针对亚洲人群的研究结果显示,醋酸格拉替雷能显著降低RRMS患者年复发率(42%),治疗后新发钆增强T 1病灶数减少65.66% [ 79 ] 。GALA研究结果证实,醋酸格拉替雷40 mg/ml,3次/周也可显著降低RRMS患者年复发率(34%),明显减少钆增强T 1病灶数(44.8%)和新发/新扩大T 2病灶数(34.7%) [ 80 ] 。另外有研究者观察到,醋酸格拉替雷在1~3年的治疗过程中,可有效减缓患者脑萎缩,使脑体积和灰质体积损失显著减少 [ 81 ] 。Ⅲ期拓展研究随访长达27年 [ 82 ] ,其结果显示,仍有40.3%患者EDSS评分改善或维持稳定,长期安全性和耐受性良好,未出现新的安全性问题。醋酸格拉替雷是目前唯一获批(欧盟)可用于妊娠和哺乳期女性患者的DMT药物,也是唯一FDA批准为B级(动物研究无风险或孕妇对照研究无风险)的DMT药物 [ 83 ] 。
推荐意见:适用于成人复发型MS,包括CIS、RRMS和有复发的SPMS患者(Ⅰ级证据,A级推荐) [ 83 ] 。推荐用法:2种剂型,分别为20 mg,1次/d或40 mg,3次/周,皮下注射。常见不良反应:注射部位反应。最常见的注射部位反应为红斑、疼痛、肿块、瘙痒、水肿、炎症和超敏反应。推荐定期监测淋巴细胞计数、氨基转移酶。
(8)米托蒽醌:米托蒽醌可通过阻断DNA合成、复制、转录及抑制Ⅱ型拓扑异构酶活性对DNA产生影响,进而抑制单核细胞、巨噬细胞、树突状细胞、辅助性T细胞等免疫细胞的免疫活性及抗原递呈效果,进而达到降低自身免疫对CNS轴突髓鞘的攻击及损伤,发挥治疗效果 [ 84 ] 。
推荐意见:几项研究结果证实,米托蒽醌治疗可以减少RRMS患者的复发率(Ⅱ级证据,B级推荐);延缓RRMS、SPMS和PRMS患者的疾病进展(Ⅲ级证据,C级推荐),但由于其严重的心脏毒性和白血病等不良反应,建议用于快速进展、其他治疗无效的患者(Ⅲ级证据,C级推荐) [ 85 , 86 , 87 , 88 , 89 ] 。推荐用法:每平方米体表面积8~12 mg,静脉注射,每3个月1次,终身总累积剂量限制在每平方米体表面积104 mg以下,疗程不宜超过2年。主要不良反应为心脏毒性和白血病,2010年一项系统性综述结果显示应用米托蒽醌治疗后,心脏收缩功能障碍、心力衰竭和急性白血病的发生风险分别为12.0%、0.4%、0.8% [ 90 ] 。使用时应注意监测其心脏毒性,每次注射前应检测左室射血分数(left ventricular ejection fraction,LVEF),若LVEF<50%或较前显著下降,应停用米托蒽醌。此外,因米托蒽醌的心脏毒性有迟发效应,整个疗程结束后,也应定期监测LVEF。
3.妊娠期和哺乳期治疗:不反对适龄MS患者计划妊娠,但需充分评估DMT治疗获益及风险 [ 18 , 91 ] 。有证据表明妊娠前疾病稳定患者与妊娠良好结局相关。对于病情持续高度活跃的患者,应先积极控制疾病,可适当推迟妊娠计划 [ 92 , 93 ] 。妊娠期间应用醋酸格拉替雷是安全的 [ 18 , 31 , 32 , 83 , 94 ] 。产后1~6个月,MS进入较为活跃阶段,应尽早开始或维持DMT,以预防复发 [ 94 ] 。在妊娠期进行磁共振平扫、针对复发相关甲泼尼龙冲击治疗及IVIG治疗是安全的 [ 22 , 91 , 95 ] 。
4.对症治疗:在MS的治疗过程中,症状管理是MS治疗不可或缺的一部分,对症治疗应将药物治疗和非药物治疗相结合。现将MS常见症状及相应的对症治疗方式归纳为 表3 [ 96 , 97 ] 。
MS最普遍的症状之一是步行障碍,对于患者日常生活有巨大影响 [ 98 , 99 ] ,可表现为行走速度降低、行走耐力下降、和(或)行走或站立时姿势稳定性变差。非药物康复方法包括运动训练、理疗和步态训练,可以通过中枢和外周机制促进步行能力改变 [ 98 ] 。氨吡啶是唯一获批用于改善MS步行障碍的药物。氨吡啶可通过阻断钾通道恢复脱髓鞘神经纤维的信号传导 [ 100 , 101 ] 。多项临床研究结果已证实,氨吡啶治疗可显著改善MS患者运动功能障碍,显著提高患者步行速度,使25英尺步行试验的步行速度显著改善 [ 102 ] 。
5.康复治疗及生活指导:MS患者的康复治疗至关重要。伴有肢体、语言、吞咽等功能障碍的患者应早期在专业医生的指导下进行相应的功能康复训练。推荐医务工作者对患者及亲属进行宣教指导,提高对疾病的认识。强调早期干预、早期治疗的必要性,合理交代病情及预后,增加患者治疗疾病的信心,提高治疗的依从性。此外还应在遗传、婚姻、妊娠、饮食、心理及用药等生活的各个方面提供合理建议,包括预防接种咨询、避免过热的热水澡和强烈阳光下高温暴晒、保持心情愉快、不吸烟、作息规律、适量运动、补充维生素D等。
本指南的推荐等级和证据级别见 表4 。
执笔 黄德晖(解放军总医院第一医学中心)、徐雁(中国医学科学院北京协和医院)
专家委员会成员(按姓名拼音顺序排序)卜碧涛(华中科技大学同济医学院附属同济医院)、常婷(空军军医大学唐都医院)、陈晟(上海交通大学医学院附属瑞金医院)、成江(宁夏医科大学总医院)、段瑞生(山东第一医科大学第一附属医院)、冯慧宇(中山大学附属第一医院)、冯娟(中国医科大学附属盛京医院)、付莹(福建医科大学附属第一医院)、管阳太(上海交通大学医学院附属仁济医院)、郝峻巍(首都医科大学宣武医院)、侯世芳(北京医院 国家老年医学中心)、黄德晖(解放军总医院第一医学中心)、金涛(吉林大学白求恩第一医院)、金薇娜(国家神经系统疾病临床医学研究中心)、李春阳(内蒙古医科大学附属医院)、李晓玲(兰州大学第二医院)、刘洪波(郑州大学第一附属医院)、刘建国(解放军总医院第六医学中心)、刘明媛(上海中医药大学附属岳阳中西医结合医院)、龙友明(广州医科大学附属第二医院)、马洪山(大同市第三人民医院)、戚晓昆(解放军总医院第六医学中心)、邱伟(中山大学附属第三医院)、全超(复旦大学附属华山医院)、施福东(首都医科大学附属北京天坛医院 神经病学中心 国家神经系统疾病临床医学研究中心)、檀国军(河北医科大学第二医院)、唐玉兰(广西医科大学第一附属医院)、汪鸿浩(广州市第一人民医院)、王化冰(首都医科大学附属北京天坛医院)、王佳伟(首都医科大学附属北京同仁医院)、王胜军(山东大学齐鲁医院)、徐雁(中国医学科学院北京协和医院)、徐竹(贵州医科大学附属医院)、杨春生(天津医科大学总医院)、杨春晓(哈尔滨医科大学附属第二医院)、杨欢(中南大学湘雅医院)、张存金(四川省人民医院)、张美妮(山西医科大学第一医院)、张勤(四川大学华西医院)、张旭(温州医科大学附属第一医院)、赵奕楠(中国医科大学附属第一医院)、周官恩(天津市环湖医院)
指南特邀评审专家 董会卿(首都医科大学宣武医院)、杨丽(天津医科大学总医院)、王丽华(哈尔滨医科大学附属第二医院)、薛群(苏州大学附属第一医院)、冯金洲(重庆医科大学附属第一医院)
参考文献略



















暂无评论内容